学科动态
北京大学周永胜 汤富酬 乔杰研究团队合作在单细胞水平鉴定人类胚胎长骨骨髓间质干细胞
间充质干细胞(MSC)是目前应用于骨再生研究领域的主要种子细胞。但到底什么是MSC呢? 1970年左右,Friedenstein的工作首次证明了长骨骨髓中存在具有CFU-Fs活性的细胞。1991年,美国生物学家Arnold Caplan首次将“间充质干细胞”(MSC)一词用于骨髓衍生的一种细胞类型,并认为间充质干细胞理论上能够通过一系列特异性的谱系转变分化为多种终末分化细胞类型。在同一时期,MSC便开始应用于临床。不同于其他研究领域,MSC研究领域是一个科学研究和临床应用研究几乎平行进行的领域。1999年,科学家证实了MSC在体外具备三系(成骨、成脂、成软骨)分化潜能。后续领域内的大量研究对于MSC的定义主要集中于以下两点:具有CFU-Fs活性以及具有体外分化潜能。因此,大量MSC相关研究都是基于体外贴壁培养的细胞得出的结论。近十年,通过基因编辑小鼠,我们对MSC的认识越来越深入。但直到目前,不管是小鼠还是人类,体内MSC的真实身份均没有定论。与此同时,以MSC为基础的细胞治疗会出现和预期不符的效应。因此,针对MSC研究和应用领域的争议,亟需开展深入的研究。
近日,北京大学口腔医院周永胜教授团队、北京大学汤富酬教授团队与北京大学第三医院乔杰院士团队合作,在《Signal Transduction and Targeted Therapy》在线发表了题为“Characterization of mesenchymal stem cells in human fetal bone marrow by single-cell transcriptomic and functional analysis”的研究论文,该研究首次利用人类胚胎长骨骨髓样本,结合单细胞转录组分析以及体内、体外系统的功能实验,在单细胞分辨率鉴定了人类长骨骨髓中两类间质干细胞类群。其中,由单个CD44+CD73+TM4SF1+骨髓间质细胞扩增的单克隆能够在移植后在体内高效成骨;而单个LIFR+PDGRB+细胞衍生的单克隆则能在移植后有效重塑骨髓腔。而且该研究发现人类胚胎发育早期(11周以前)和胚胎发育后期,骨髓间质细胞各亚群特异性转录因子的表达呈现各自独特的特点。胚胎骨髓间质细胞的CFU-Fs活性分析发现,CD51, CD90和CD73等领域内常用于分选MSC的标志基因在几乎所有的单克隆中都高表达。被用于分选人MSC的经典标志基因 CD271和CD146, 前者(CD271)在所有的单克隆里都不表达;而后者(CD146)仅在部分单克隆里高表达。进一步分析发现,骨髓间质细胞CFU-Fs中,只有极少数来自于CD44+CD73+TM4SF1+和LIFR+PDGRB+的细胞是真正的干细胞类群。可见,绝大部分骨髓CFU-Fs虽然是CD51+CD90+CD73+的,但是在移植后均不具备体内多向分化潜能。
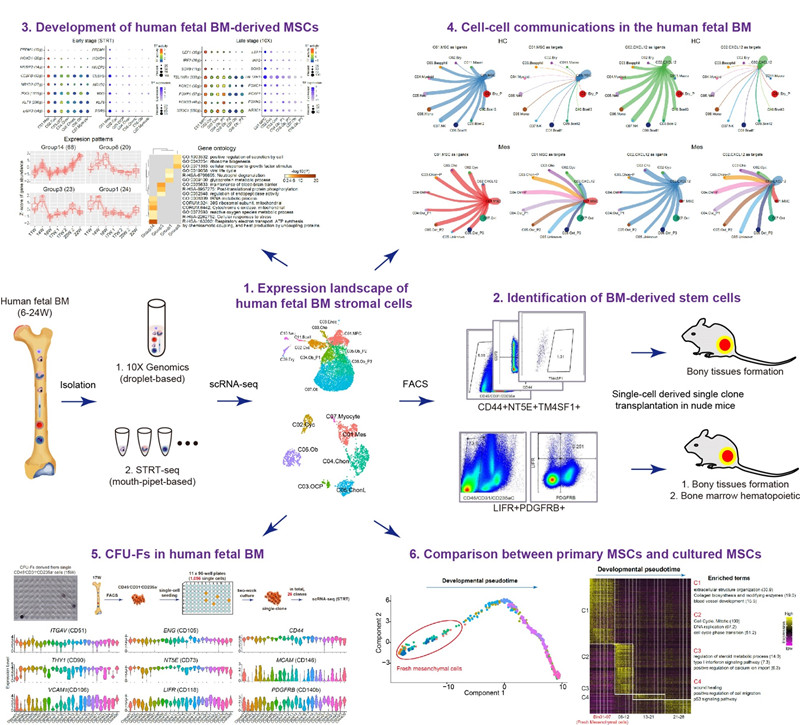
CD44+CD73+TM4SF1+和 LIFR+PDGRB+间质干细胞类群在骨髓间质中所占的比率均非常低,远远达不到临床转化应用所需要的细胞数量级别。为了探索上述新鲜分离的间质干细胞在体外安全有效的培养条件,该研究首先在单细胞水平比对了体外培养前后骨髓间质细胞的差异,实验发现在体外培养过程中骨髓间质细胞会快速经历“无规则分化-衰老”的历程。特别值得一提的是,与新鲜分离的骨髓间质细胞相比,贴壁培养后,细胞中CD90, CD73和CD105等领域内常规用于分选MSC的表面标志基因的表达均显著增加,而LIFR表达则显著下调。此外,该研究在单细胞水平也深入探究了MSC在体内所处的微环境。通过分析骨髓各细胞类群的相互作用关系发现,与之前造血领域的研究报道一致,骨髓间质细胞确实对血系细胞有重要的支持作用;反过来,血系细胞对骨髓间质细胞则并非如此。对骨髓间质干细胞起重要支持作用的,是其它间质细胞亚群(软骨细胞和成骨细胞类群等),而不是血系细胞。该研究一方面拓展了对于人类骨髓间质干细胞的认识,另一方面也为后续进一步在体外构建骨髓间质干细胞的最佳培养和扩增条件奠定了基础。分离和鉴定骨组织相关成体干细胞并实现其在体外的有效扩增,将有利于实现真正意义上的骨再生。
北京大学口腔医院副研究员张萍,北京大学博士董骥,博士后范小英为该论文的共同第一作者。北京大学口腔医院周永胜教授、北京大学汤富酬教授与北京大学第三医院乔杰院士为共同通讯作者。该成果得到了国家自然科学基金重点项目、北大-清华生命联合中心等项目的资助。
文章全文链接:https://www.nature.com/articles/s41392-023-01338-2












 我想进修
我想进修 环境信息公开
环境信息公开 招聘信息
招聘信息 临床实验者招募
临床实验者招募 急诊就医
急诊就医 我想住院
我想住院 结果查询
结果查询 我想表扬
我想表扬 意见反馈
意见反馈