科研动态
北大口腔王宇光团队《Advanced Materials》:蛋白质衍生超分子介导的癌症光学诊疗
近日,北京大学口腔医院口腔生物材料和数字诊疗装备国家工程研究中心的王宇光副教授团队在纳米材料领域国际知名期刊《先进材料》(《Advanced Materials》期刊)上发表蛋白质衍生超分子用于体内多模态成像引导的光动力和光热免疫抗肿瘤治疗的研究,该研究对癌症一体化诊疗研究领域具有重要意义。研究从癌症微创诊疗的角度出发,提出了一种涉及生物标志物蛋白激活的新型超分子诊疗策略,这种超分子主-客体活化纳米颗粒能够作为一种纳米光疗药物进一步结合免疫疗法高效治疗头颈癌,克服了传统光动力材料的穿透深度缺陷,且有望对远端转移癌起到很好的治疗效果,尤其适用于解决颌面部淋巴结丰富区域的转移癌难题。
该研究与北京化工大学合作完成,程红波教授、硕士谭晓琼与北大口腔医学院黄明伟主任医师的硕士研究生戴好为并列第一作者,王宇光副教授与北京化工大学张立群院士、韩国Juyoung Yoon教授作为并列通讯作者。
研究背景
癌症是一种全球范围内的疾病,严重威胁着人类的生命健康,头颈癌作为解剖位置相对表浅的癌种,其易于操作的特性和功能保存的需求尤其适用于微创性疗法。光疗作为一种时空响应的非介入疗法在癌症治疗领域广受关注,然而现有的光疗分子受限于复杂的设计合成、潜在毒性和光活性变化等问题亟需解决。
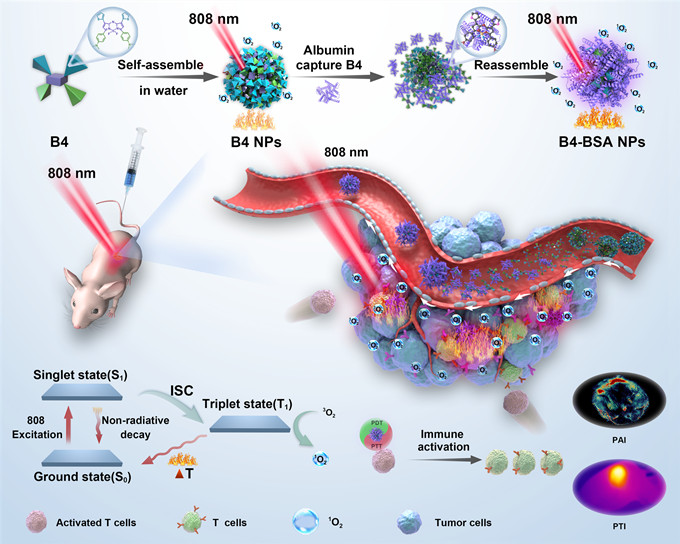
图1、 B4 NPs自组装后实现光动力/光热诊疗并激活免疫反应模式。
针对以上临床痛点,我们研发了具有近红外光响应性的新型BODIPY分子由体内蛋白激活自组装为纳米颗粒B4 NPs,其光热转换性能和单线态氧产生在纳米尺度下显著提高。通过4T1-Balb/c裸鼠模型证实BODIPY在体内特异性结合蛋白,具有光热/光声成像诊断潜力用以成像引导下的癌症治疗,进一步通过SCC7-C3h小鼠模型证实B4 NPs联合免疫检查点阻断剂α-PD-1实现光热/光动力/免疫的抗肿瘤协同治疗。
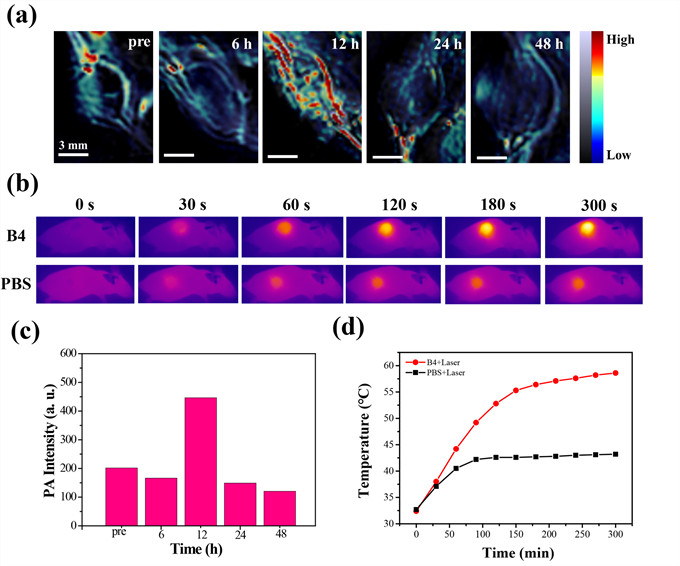
图2、体内生物标记物蛋白质活化后的活体光热/光声成像用以癌症可视化诊断和成像引导下治疗。
综上所述,作者通过精心设计,制备了一种高性能、稳定的、具有生物蛋白质响应活化特征的有机超分子光热/光动力材料,提出了超分子主体-客体生物蛋白质标记物活化策略,实现了多模式成像引导下的非介入式癌症光疗,获得了光诊疗有机分子设计合成的重大突破。在此基础上,构建了生物标记物蛋白质响应组装的光疗纳米颗粒B4 NPs,其显著提高了光热转换效率至60.02%。该工作展现了结构多样、性能易调的超分子光热/光动力材料在头颈肿瘤治疗方面的巨大潜力,将会抛砖引玉,促进更多高效的癌症光诊疗纳米材料开发。
文献链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202109111
Adv. Mater. 2022,DOI:10.1002/adma.202109111
作者简介
王宇光, 副教授,副主任医师,博士生导师,中组部万人计划青年拔尖人才支持计划获得者。毕业于北京大学医学部,口腔医学博士,美国哈佛大学麻省总医院访问学者。现任北京口腔医学会激光专委会常务委员,中华口腔医学会激光专委会青年委员等。主要研究方向为可见光调控的口腔硬组织缺损修复,光响应材料在抗菌抗肿瘤方面的应用等。主持多项国家及部委级课题和国际合作项目。













 我想进修
我想进修 环境信息公开
环境信息公开 招聘信息
招聘信息 临床实验者招募
临床实验者招募 急诊就医
急诊就医 我想住院
我想住院 结果查询
结果查询 我想表扬
我想表扬 意见反馈
意见反馈